- 科研动态
- Research Dynamics



一提到细菌就害怕?别怕!细菌可以说是无处不在,它们和我们的身体和平共处。细菌也有“好坏”之分,有的细菌更是我们身体健康的“大功臣”!本期#材料轻Talk,让我们来看看细菌作为载体有什么样的治疗应用与优势吧!
细菌对低氧、营养丰富和免疫抑制的肿瘤微环境表现出一定的趋化性,自身的鞭毛又可以使其具自主运动的能力,另外其拥有可操纵的基因和表面有丰富的基团,因此细菌毋庸置疑是介导肿瘤治疗的良好载体。
细菌介导的肿瘤治疗已经有很长的历史了,早在19世纪初就有医生发现感染产气荚膜梭菌的患者体内的肿瘤消退。后来也有医生通过瘤内注射消退了患者的纤维肉瘤。但是由于当时医疗技术受限,细菌介导的肿瘤治疗一度由于体内无法控制的感染而被终止。直到20世纪90年代,随着研究人员对肿瘤微环境和肿瘤免疫学更全面的了解,以及大量抗生素的发展,许多关于基因工程和合成生物学的研究开始研究活菌在癌症治疗中的应用。具有固有肿瘤定植能力的减毒细菌已被合理设计用于肿瘤靶向传递各种不同化合物,以增强基于细菌的癌症联合治疗。下边将对以细菌为载体的生物应用进行具体阐述。
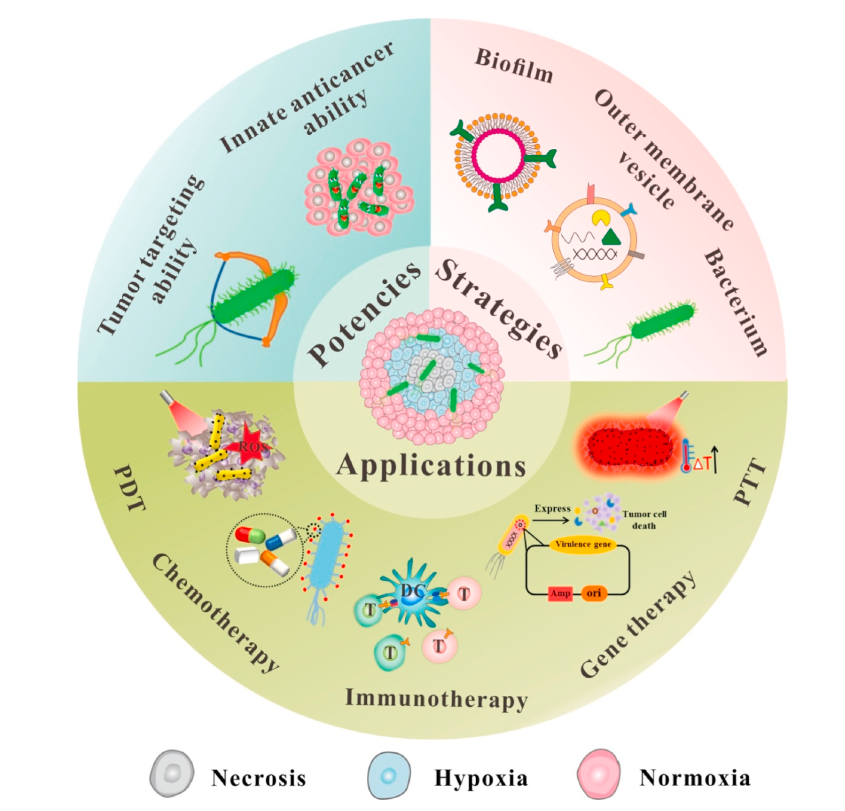
▲ 图1:细菌为基础的肿瘤治疗应用[1]
 基因编辑
基因编辑
由于细菌的基因操纵的可行性好,易于控制,因此可以通过基因修饰来提高其有效性。目前,针对细菌进行肿瘤治疗的基因编辑策略主要有四种:抗肿瘤细胞因子的表达、免疫调节剂的表达、成像引导信号蛋白的表达和前药转化酶表达。
在癌症治疗中,在保护健康组织的同时靶向输送有毒药物或蛋白质是一种理想的策略。许多天然细胞毒性药物,如肿瘤坏死因子-α(TNF-α)、Fas配体和细胞溶血素A(ClyA)显示出很有希望的细胞杀伤作用,但由于单一制剂的半衰期短和对肝功能的有害影响,这些药物受到肿瘤暴露不足的限制。为了提高这些药物的生物利用度,细菌被用来将它们直接输送到肿瘤区域。Fan等人利用大肠杆菌MG1655设计了一种无创热敏系统,该系统可通过口服给药实现肿瘤光热治疗。该系统的一个优点是,通过修饰在细菌上的生物矿化金纳米粒子(AuNP)的光热效应,肿瘤中TNF-a的表达可以局部调控。细胞溶血素作为一种造孔蛋白,通过在靶细胞膜上形成纳米通道而引起细胞损伤。Ryan等人利用转基因非致病性鼠伤寒沙门氏菌,将编码细胞毒性溶细胞蛋白(HlyE)的基因传递到实体肿瘤的缺氧区域。结果表明,HlyE在血管化较差的肿瘤区域特异性表达,增强肿瘤坏死,抑制肿瘤生长
当细菌在肿瘤区域定植时,高度表达IL-2、CCL21和IL-18等免疫调节细胞因子的特制工程菌可以在原位增强显著的免疫反应。作为细菌递送系统中研究最多的细胞因子之一,口服或静脉注射表达IL-2的沙门氏菌可预防动物模型中的肿瘤形成。Loefler等人使用减毒鼠伤寒沙门氏菌表达CCL21趋化因子以提高抗肿瘤效果。他们发现肿瘤组织中的炎性细胞浸润显著增加,相关的细胞因子和趋化因子如INF-γ、CXCL9和CXCL10也升高。这种免疫调节蛋白递送系统可显著抑制小鼠原发性肿瘤和肺转移性结节的生长,且无明显毒性。除了经典的细胞因子和趋化因子外,肿瘤靶向细菌传递的其他蛋白也显示出免疫调节作用。例如,异源鞭毛蛋白已被用作一种有效的免疫调节剂。Zheng等人报道了分泌创伤弧菌鞭毛蛋白B(FlaB)的工程化鼠伤寒沙门氏菌ΔppGpp菌株在肿瘤微环境中诱导了显著的宿主反应,并激发了M1样巨噬细胞的激活,与亲本菌株相比,这大大抑制了体内肿瘤的生长和转移,延长了荷瘤小鼠的存活时间
近年来,集成像和治疗功能于一体的热疗药物已成为抗肿瘤治疗研究的热点。基于细菌介导的生物发光和荧光的光学成像技术不仅可以检测肿瘤中成功的细菌定位以预测其增殖,而且可以提高癌症的诊断和治疗。例如,Sae Ryung Kang等人使用18F-FDS PET来可视化肿瘤靶向大肠杆菌MG1655在CT-26荷瘤小鼠模型中的定植和增殖。携带细菌荧光素酶基因lux、RLuc8或GFP的鼠伤寒杆菌已被工程化,通过实时成像显示其在肿瘤中的分布。这些成像技术能够实时监测不同小鼠肿瘤模型中细菌向原发性和转移性肿瘤的迁移。
已建立的重组细菌可将非活性前药在肿瘤部位转化为活性形式,从而显著提高局部药物浓度,并减少全身给药后的非靶向效应。例如,在小鼠模型和人类受试者中,使用沙门氏菌将胞嘧啶脱氨酶靶向传递到肿瘤组织导致5-氟胞嘧啶(5-FC)局部转化为有毒的5-氟尿嘧啶(5-FU)。细菌酶羧肽酶G2已被用于将氮芥前药转化为DNA损伤剂,“自杀基因导向化疗”大大提高了疗效和安全性。然而,并非所有的前药都可以通过细菌酶反应转化,转化效率受到系统生物合成和代谢活性的限制,这阻碍了它们的临床应用。
 细菌/纳米材料复合材料的构建
细菌/纳米材料复合材料的构建
除了基因改造细菌外,还有许多方法可以将细菌转化为具有多种功能的抗癌药物。根据细菌的不同治疗应用,我们将这些方法分为三类:(1)细菌作为治疗剂,通过纳米合成技术进行修饰,以增强其肿瘤靶向性和穿透能力;(2)以细菌为载体,将生物合成技术与其他功能纳米材料相结合,实现肿瘤的多功能诊断和治疗;(3)细菌分泌物与纳米材料结合以增强抗肿瘤效果和激活免疫反应。简而言之,传统纳米材料的缺点,如靶向性差、人体识别速度快、副作用严重等,只要与细菌结合,无论细菌是作为治疗剂、靶向载体还是免疫激活剂,都可以在很大程度上解决,它可以显著提高抗肿瘤效果,为开发新的抗肿瘤治疗策略提供了强大的潜力。
由于细菌进入宿主体内后,不可避免地会被网状内皮系统吞噬和清除。因此,通过表面修饰的工程菌可以延长其在循环中的滞留时间进而提高肿瘤部位的优先聚集来进一步提高抗肿瘤效果。合成聚合物、脂质体和生物膜等均可用于细菌表面修饰,以提高其诊断、成像和治疗的安全性和效率。例如使用红细胞膜包裹大肠杆菌用于延长其在血液中的长循环时间进而增强肿瘤部位蓄积。再如,使用具有光热吸收功能的多巴胺包裹沙门氏菌可以增强其光热治疗肿瘤效果。
化疗是临床治疗恶性肿瘤最常用的策略之一。然而,由于肿瘤缺氧区畸形的血管和较高的间质压,大多数药物载体从肿瘤血管系统“泄漏”并分布在周围区域,这反过来又将药物剂量降低到次优水平,降低了治疗效果。而细菌载体可以将化疗药物递送并释放到更深的肿瘤区域。例如使用pH不稳定的顺式乙酸酐连接剂将阿霉素(DOX)连接到大肠杆菌Nissle 1917(EcN)上,构建了一种药物偶联细菌游泳者(EcN ca DOX)。EcN ca DOX在肿瘤中积累,并以可控、酸反应的方式缓慢释放药物。静脉注射EcN ca DOX 3小时和3天后,肿瘤中的DOX累积量分别为每克组织注射剂量的12.9%和6.4%,而单剂量治疗组肿瘤部位的DOX几乎完全消除。Suh等人开发了一种纳米级细菌自主给药系统(NanoBEADS),在没有任何外部刺激的情况下,将输送至实体肿瘤的纳米粒子数量增加了近100倍。最近,开发了新型细菌微丸,用于上传、输送和卸载封装DOX和a-生育酚琥珀酸盐的混合胶束。由于在细胞核和线粒体中分别同时释放DOX和a-生育酚琥珀酸,胶束和细菌的结合实现了协同抗肿瘤作用。此外,Felfuight等人使用磁性趋气细菌海洋磁球菌MC-1菌株将载药纳米脂质体输送到肿瘤的氧-缺氧过渡区(OATZ)。同样,Zoaby等人将DOX载药纳米脂体整合到沙门氏菌上,沙门氏杆菌通过其自主推进能力快速迁移到低pH和高葡萄糖水平的肿瘤区域。与此相一致,Nguyen等人发现鼠伤寒沙门氏菌能够将紫杉醇脂质体输送到肿瘤组织,与游离药物包裹的脂质体相比,其具有更大的功效,因为其具有较高的运动性和向肿瘤的倾向性,从而具有更好的抗肿瘤效果。
光热治疗的效果如何取决于光热剂的光热转换效率和肿瘤中的选择性蓄积。然而,目前使用的光热剂在肿瘤中的积累相对较差,这限制了其临床疗效。细菌可以显著改善光热剂在肿瘤坏死和缺氧区域的分布。Luo等人报告说,厌氧菌可以将纳米材料输送到缺氧肿瘤区域进行成像和PTT。Chen等人设计了一个生物/非生物杂交系统,该系统由高能动性鼠伤寒沙门氏菌株YB1和负载光敏剂吲哚青绿(INPs)的NPs组成,用于靶向大型膀胱肿瘤(≥500毫米3)。YB1增强了INP对肿瘤缺氧部位的渗透,在近红外(NIR)激光照射后,INP能够实现肿瘤细胞的光热裂解。因此,释放的营养素进一步吸引了细菌,并使肿瘤部位的YB1 INP积累量增加了14倍,与未辐照对照组相比。因此,YB1 INPs通过PTT抑制大实体瘤的生长,且无复发。Chen等人利用沙门氏菌VNP20009的肿瘤靶向能力将多聚多巴胺运输到缺氧肿瘤区域,进行PTT和免疫治疗的联合,PTT导致肿瘤细胞消融并释放大量肿瘤相关抗原,从而引发免疫反应。沙门氏菌和PD-1阻断剂通过阻断免疫检查点进一步增强抗肿瘤反应。这种策略抑制了大型黑色素瘤的生长,并防止其复发。
光动力治疗因其侵袭性小、副作用少和耐药风险低而被广泛用于癌症治疗。它使用光敏剂光激活后产生活性氧(ROS),进而诱导细胞凋亡、坏死和组织破坏。然而,由于缺氧性肿瘤微环境以及光敏剂的耗氧量进一步加剧肿瘤部位的缺氧,光动力的疗效有限。放氧纳米材料可以缓解肿瘤缺氧,增强光动力的作用。同样,产氧光合细菌可以潜在地改善光动力期间的肿瘤氧合。由于蓝藻菌株Syenchoccus 7942(Syne)具有肿瘤靶向性和原位光催化产氧能力,因此可以被用作光动力的供养菌。Liu等人利用分子间二硫键组装光敏NP(HSA/ICG),并通过酰胺键将其结合到Syne细胞壁上。由此产生的仿生系统(S/HSA/ICG)实现了光敏剂的靶向肿瘤递送,并通过原位产生高水平氧气。
S/HSA/ICG NPs的光合作用在肿瘤中富集,并在激光照射下持续产生氧气,显著缓解肿瘤缺氧,从而完全逆转免疫抑制性TME,增强光动力治疗效应。另一组通过酰胺反应将PS氯e6(ce6)附着在蓝藻表面,为光动力治疗合成了类似的蓝藻/PS杂交。在660 nm激光刺激下,杂交系统通过光合作用产生O2,PS将其转化为单线态氧。这种正反馈级联在低剂量ce6的17.9倍下,实现了与传统ce6介导的光动力治疗相似的光动力效应,并成功地在异种移植模型中消融了肿瘤生长。细菌生物矿化也应用于光动力治疗。
此外细菌还可以通过基因编辑手段用于表达抗肿瘤血管生成因子。通过生物合成技术用于递送溶瘤病毒或者放射性材料用于肿瘤的多功能疗法。除了上述利用细菌作为生物载体外,细菌的天然佐剂成分还可以有控制地刺激免疫成熟和诱导炎症,增加肿瘤免疫浸润。虽然细菌具有自主驱动性、肿瘤靶向性、易操纵的基因等等优势使其在肿瘤治疗领域有了新的用途。毋庸置疑的是,细菌的自主繁殖可能会给机体带来不可控的感染风险。
更多新潮科研资讯,欢迎持续关注同萃生材#材料轻Talk专栏!
特别鸣谢:刘瑶
参考文献:
[1] Bacterial-based cancer therapy: An emerging toolbox for targeted drug/gene delivery, Biomaterials,10.1016/j.biomaterials.2021.121124
[2] Engineering the perfect (bacterial) cancer therapy, Nat Rev,Canc
er, 10.1038/nrc2934
[3] Bacteria-Based Cancer Immunotherapy, Adv Sci,10.1002/advs.202003572