- 科研动态
- Research Dynamics



初夏,新一季《乘风》如约而至,姐姐们的美踏着夏天的热浪,再次成功击中万千网友的心窝窝。
然而,最让小编难忘的还是那年第一季中,“追她需要去法国排队”的咱山东大嫚!姐姐把未知的X卡当作加冕的王冠,稳稳地站在荣耀的C位。
她说,X=无限可能。
其实,水凝胶也堪称是近两年材料研究领域无限可能般的存在。X+水凝胶直接BUFF值叠满!继上期带来席夫碱凝胶的介绍后,本期#材料轻Talk,我们将视线聚焦在多肽水凝胶的研究进展,看它如何无惧乘风,BUFF叠满。

水凝胶是一类具有三维网状结构的亲水高聚结合体,由天然或合成高分子材料经过物理或化学方法交联制成,其自身不溶于水,但能够吸收大量的水分或体液而膨胀[1]。当选用的高分子为多肽类时(胶原、聚L-赖氨酸、聚L-谷胺酸等),形成的水凝胶就称为多肽水凝胶(Peptide Hydrogel),也可以称为蛋白质水凝胶。由于多肽凝胶具有高吸水性、良好生物组织相容性、可控降解性以及环境响应性等优点,在材料科学、生物医学、临床医学等领域受到越来越多的关注。
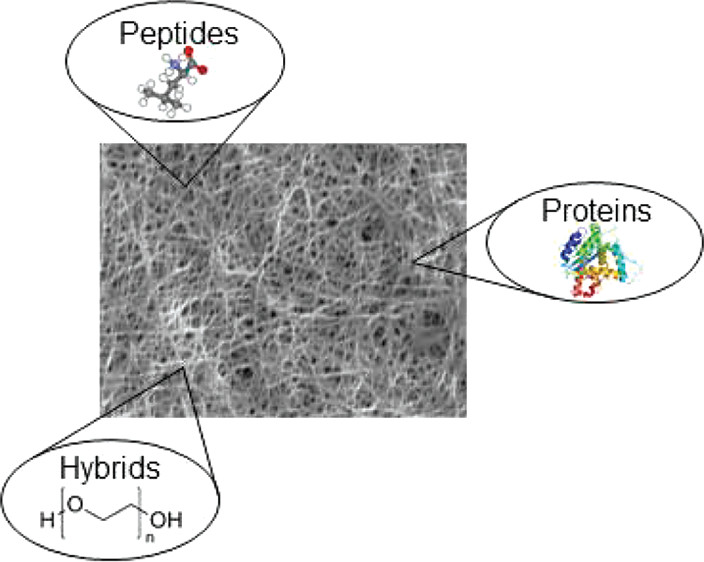
▲ 图1:基于肽和蛋白质的水凝胶[2]

分散在水溶液介质中的聚合物链通过多种机理发生交联后,形成水凝胶。这些机理包括:物理纠缠、离子反应、化学交联等,具体的机理由聚合物的内在特性决定[3]。根据高分子网络内部交联方式的不同,多肽类水凝胶可以分为多肽类化学凝胶和多肽类物理凝胶[4]。
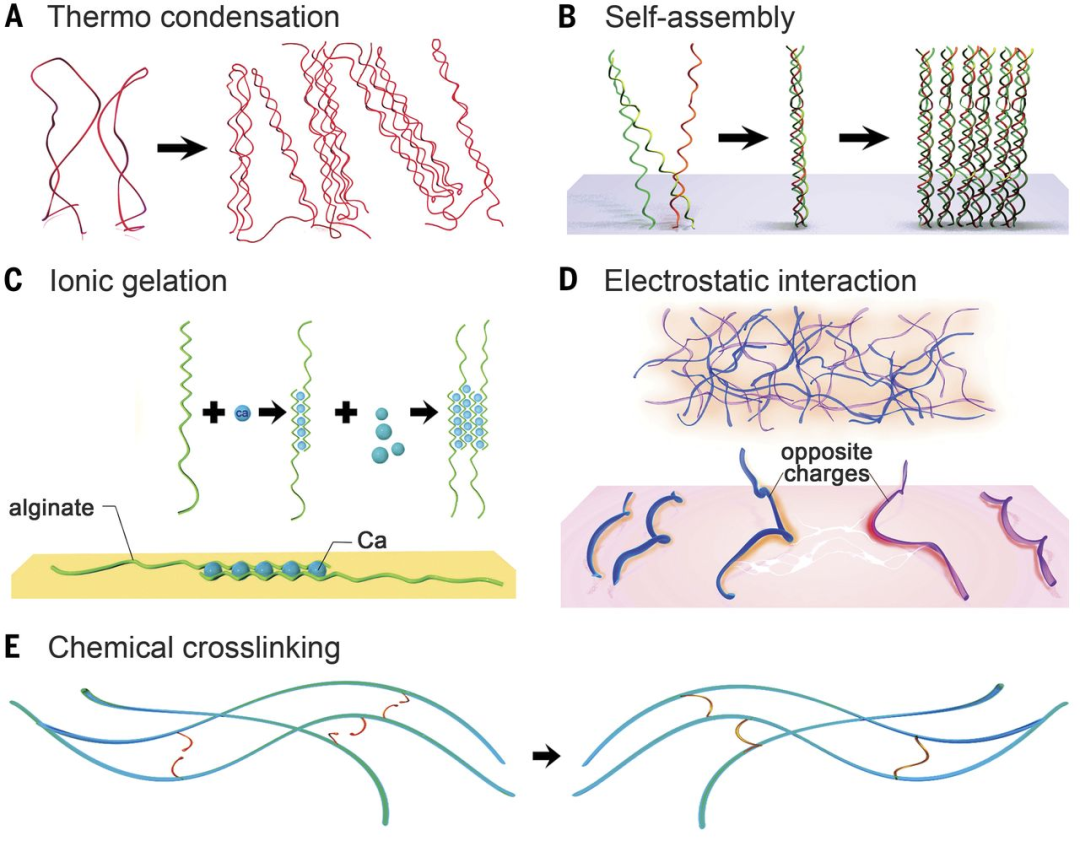
▲ 图2:水凝胶的交联。(A至D)物理交联。(A)热诱导聚合物链的缠结。(B)分子自组装。(C)离子凝胶化。(D)静电相互作用。(E)化学交联[3]

多肽物理水凝胶通过氢键、离子键、π-π堆积、静电相互作用或疏水相互作用等物理交联方法制备。与化学交联相比,通过物理交联形成水凝胶往往比化学交联形成水凝胶的速度更快,不需要添加化学交联剂,可以在一定的外部刺激,如pH和温度下自组装形成,并且形成水凝胶的过程是可逆的[5, 6]。总之,多肽物理水凝胶主要通过非共价分子自组装的方法实现,这也是形成蛋白质水凝胶的常见策略。
鉴于在特定环境变化下,物理交联结构容易被破坏,因而多肽物理水凝胶在某些领域有重要的应用前景,例如在生物医药领域用于缓释药物。虽然物理水凝胶表现出比化学水凝胶低得多的刚度和强度,但它们对各种环境刺激表现出更高的响应性;此外,这也可以作为其优势,因为它使物理水凝胶适合作为可注射材料。(图3)[2]。

▲ 图3:可注射凝胶示意图

多肽化学水凝胶的交联作用通过共价键实现, 得到的水凝胶是一种永久性凝胶, 即凝胶过程不可逆。主要实现方法有:
▶ 交联剂法:引入交联剂或者是具有反应活性的官能团, 利用多肽链中的活性反应基团与交联剂之间的反应获得凝胶网络。
▶ 光交联法:与传统的交联诱导方式不太一样,光响应性水凝胶在多肽的链中引入光敏感基团,在光(如紫外线,辐射)照射下可以进行原位聚合,能够达到时间以及空间上的精准控制。近年来,光敏性水凝胶所受的关注度也越来越高。
▶ 以支链的形式引入其他凝胶中形成杂化的或者复合型的凝胶。
多肽自组装水凝胶的形成过程,可分为两个阶段:
(1)肽的自组装,形成二级结构和纳米纤维;
(2)纳米纤维的延伸、联合和纠缠,形成三维网络[1]。

多肽自组装水凝胶形成的早期,大部分的肽首先自组装成二级结构,然后聚集成纳米纤维。根据其不同的构象,二级结构被分为三类:β-sheet、β-haircut、α-helix(图4)。每种二级结构对应相应的肽序列,并对纳米纤维的结构和最终水凝胶的性能产生重要影响。因此,肽序列和二级结构构象的设计对于制造具有不同结构和性能的自组装水凝胶至关重要。
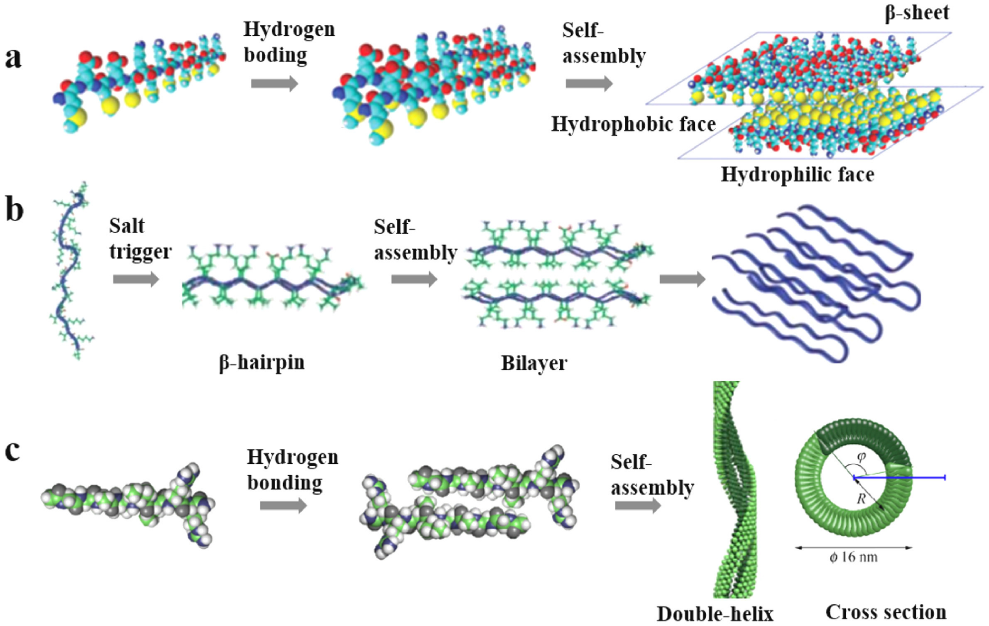
▲ 图4:肽自组装成纳米纤维的过程示意图:(a)具有β-sheet结构的肽EAK16-II。 (b) 具有β-hairpin结构的多肽MAX8。(c) 具有α-helix结构的多肽GAAVILRR[1]

在二级结构和多肽纳米纤维形成后,自组装是连续的,通过纳米纤维的延伸和纠缠可以得到最终的三维网络水凝胶。纳米纤维之间的相互作用主要由疏水残基控制。

多肽自组装水凝胶的形成过程中,外部条件起着重要的作用,环境的变化可能会大大影响所获得的水凝胶产品的结构和性能。在大多数肽的自组装过程中,可以通过调节pH值或离子强度来屏蔽氨基酸侧链之间的电荷排斥,而且在一些多肽自组装水凝胶的催化过程中使用的酶有时会赋予水凝胶产物一些特定的性质(如区域选择性)。因此,pH值、离子强度和酶是影响三维分层水凝胶形成的三个主要因素。
下表为多肽自组装水凝胶制备方法的汇总[7]。
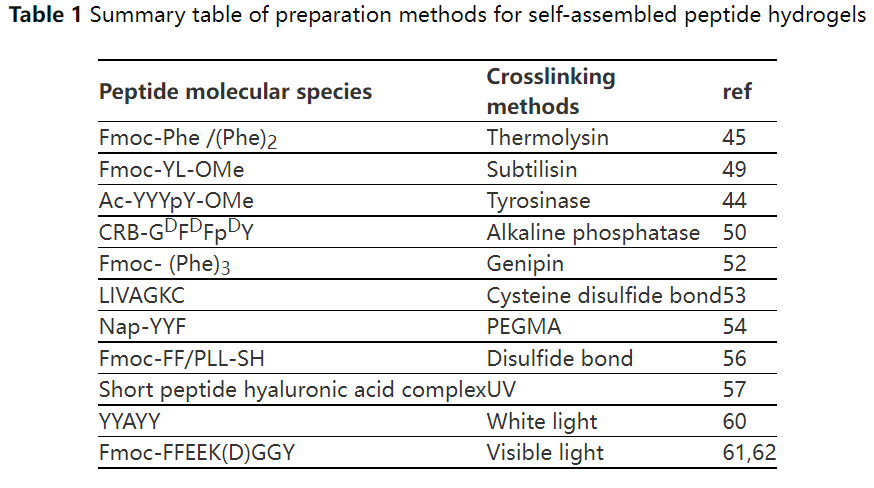

独特的自组装形成方式和网络结构为多肽水凝胶提供了特定的流变特性,肽成分为水凝胶提供了优异的生物相容性。多肽水凝胶的特性决定了它们的应用,因此在制备时应该充分考虑这一点[1]。

流变特性是多肽水凝胶影响其生物应用的最重要因素,通常由包括储存模量(G′)、损失模量(G′′)和损失因子(tanδ)等参数来表征。G'是代表材料的弹性或刚度,即水凝胶的凝固程度,其直接决定了其在生物学上的应用领域;G "代表类似液体的流动特性。G'和G "共同表征材料的粘弹性能,损失因子tanδ被定义为G′′与G′的比值(即tanδ= G′′/ G′)刚度是描述材料抵抗变形的能力的参数。

由于内部的肽成分,多肽水凝胶显示出良好的生物相容性。细胞在多肽水凝胶的作用下生长和增殖,具有很强的生命力,在其植入后很少会引起组织炎症。因此,其作为一种有前途的构件被广泛应用于生物领域,具体见下一部分。

多肽水凝胶具有水含量高、多孔结构、可调节的机械稳定性、良好的生物相容性、出色的可注射性和类天然组织的弹性等特点。此外,肽自组装水凝胶易于通过对氨基酸侧链的特异性修饰或功能化,实现特定的生物学功能。在安全性上,多肽凝胶降解时只形成氨基酸, 对机体不会产生不良影响,当导入机体后, 不会引起免疫反应和组织炎症。多肽水凝胶的上述特性使其非常适合在生物医学领域如药物输送与控释、组织工程和伤口愈合等领域的应用。图5展示了多肽自组装水凝胶的一些生物学应用[8]。
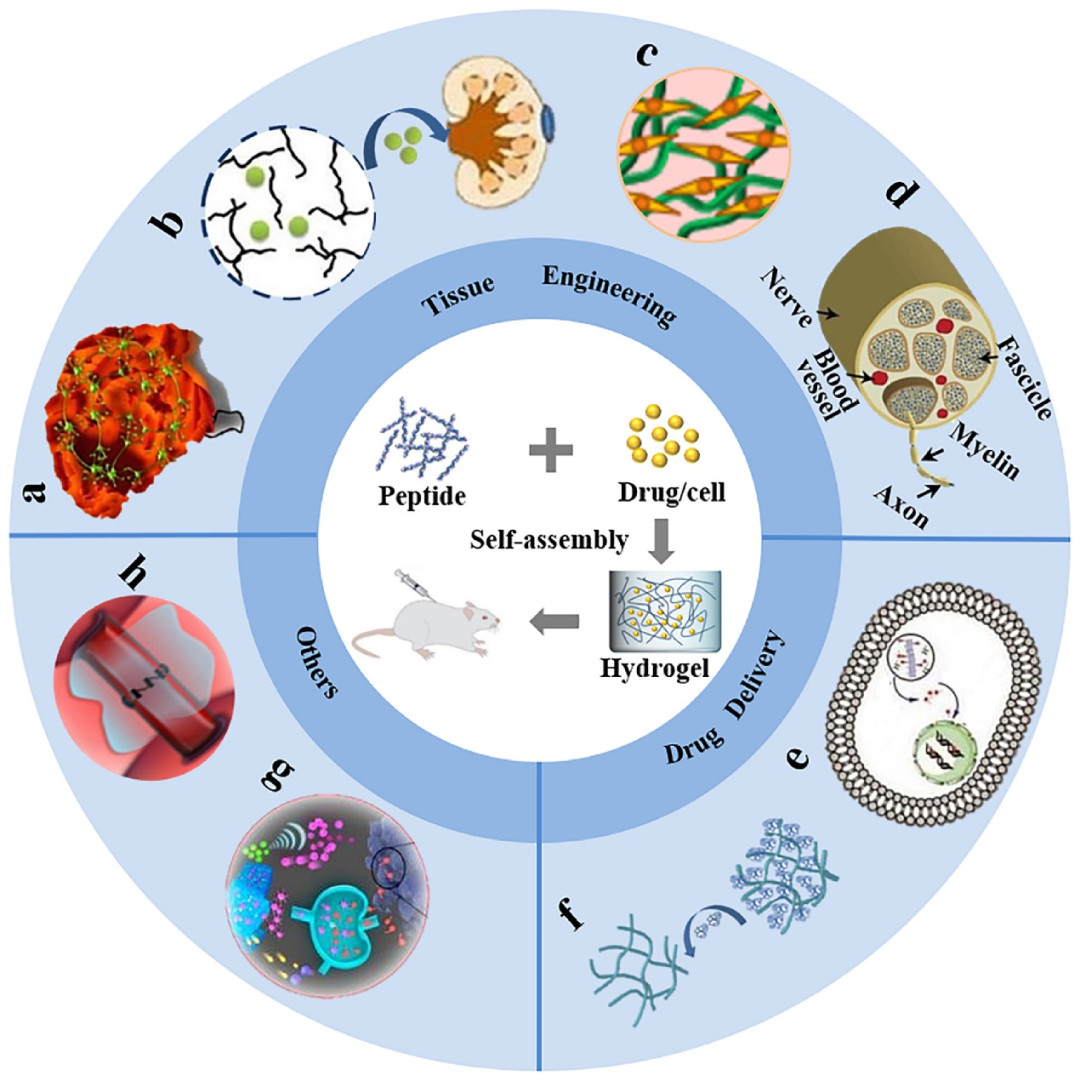
▲ 图5. 多肽水凝胶的生物学应用。包括组织工程,药物递送等,疫苗开发等[7]
▲ 图6:水凝胶的转化潜力拓展到可植入、可注射和可喷涂的生物材料[10]

与大量关于用各种聚合物和交联化学组合创造新的水凝胶的科学出版物相比,只有少数的水凝胶获得了监管部门的批准/许可,进入了临床。虽然谨慎和严格的监管过程是确保病人安全的绝对必要条件,但相关的高成本和长时限是将新材料从实验室转化为临床的最重大障碍。尽管某些水凝胶产品可以作为医疗器械被批准,与NDA相比,需要更少的临床证据,但仍然需要大量的研究活动来验证其益处和安全状况。

由于新的水凝胶总是在临床前阶段进行小规模的开发和验证,未来符合现行GMP法规的大规模生产是水凝胶转化的一个主要挑战,尤其是那些使用天然聚合物作为源材料和/或含有生物或细胞的水凝胶。

尽管有大量的材料和凝胶化学制品,但水凝胶作为一种软性材料,相对来说还是比较新的,其高度复杂的性质给科学家们带来了根本性的挑战,他们需要全面描述其化学和拓扑结构,了解其结构与性能的关系,并指导其进一步发展。


V1-Cal多肽水凝胶化增强其对梗死后心室重构和心脏功能的改善作用V1-Cal
hydrogelation enhances its effects on ventricular remodeling reduction and cardiac function improvement post myocardial infarction
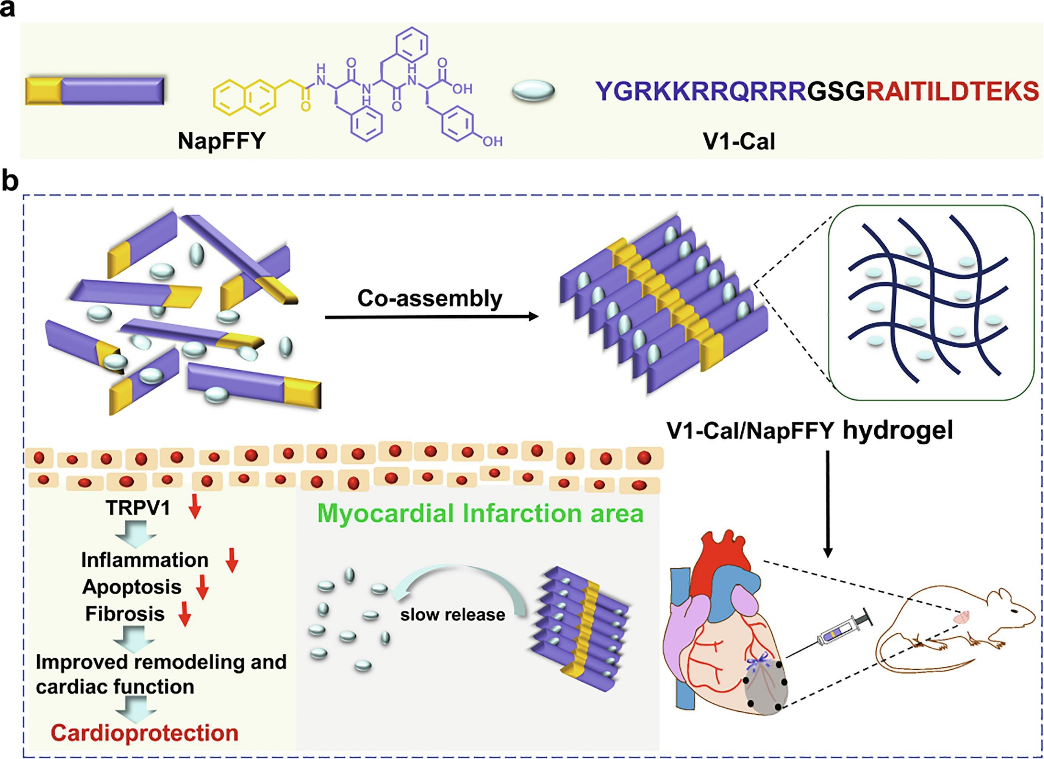
摘要:
心肌梗塞(MI)是全世界残疾和死亡的一个主要原因。一种细胞渗透肽V1-Cal已经显示出对心肌梗塞的显著治疗效果。然而,使用V1-Cal来改善心肌梗塞后的长期心脏功能,目前受到其短半衰期的限制。在此,安医大/中科大教授张野/梁高林等人将V1-Cal与水凝胶Nap-Phe-Phe-Tyr(NapFFY)共同组装,获得了一种新的超分子水凝胶V1-Cal/NapFFY。研究发现,该水凝胶可以明显增强V1-Cal在心肌梗塞大鼠模型中减少心室重构和改善心功能的治疗效果。体外实验表明,V1-Cal与NapFFY的共同组装大大增加了水凝胶的机械强度,使V1-Cal的持续释放时间超过两周。体内实验表明从V1-Cal/NapFFY水凝胶中持续释放V1-Cal可以有效减少TRPV1的表达和激活,减少细胞凋亡和MI大鼠模型中炎症因子的释放。特别是,V1-Cal/NapFFY水凝胶能显著减少梗死面积和纤维化,同时改善MI后28天的心脏功能。这种V1-Cal/NapFFY水凝胶预期在将来可以用于临床治疗MI。
原文链接:
https://doi.org/10.1016/j.cej.2021.134450
——

具有可调粘性和微孔结构的仿生糖肽水凝胶用于快速止血和高效的伤口愈合
Biomimetic Glycopolypeptide Hydrogels with Tunable Adhesion and Microporous Structure for Fast Hemostasis and Highly Efficient Wound Healing
摘要:
尽管第一代组织粘合剂和止血剂已经应用于临床,但人们对水凝胶的微观结构和止血功能与伤口愈合之间的相关性了解不多,而且难以设计出高性能的水凝胶来满足世界范围内日益增长的伤口闭合、止血和愈合的需求。受细胞外基质微观结构和贻贝模拟化学的启发,上海交通大学董常明教授等制备了两种协调共价的糖多肽水凝胶,具有可调节的组织粘附强度(14.6-83.9 kPa)和微孔结构(8-18 μm),溶血率低于1.5%。值得注意的是,微孔的大小主要控制着止血,与纤维蛋白胶和其他水凝胶相比,具有16-18 μm大孔的水凝胶实现了≈14秒的最快止血和≈6%的最低血液损失。此外,通过溶血、细胞毒性、皮下植入、止血和愈合试验评估,生物相容性和止血都影响伤口愈合性能。重要的是,糖多肽水凝胶处理的大鼠皮肤缺损模型在第14天就实现了伤口的完全闭合,并再生出厚实的真皮和表皮,还有一些毛囊。因此,这项工作建立了一种通用的方法来构建具有可调控的粘附性和微孔结构、快速止血和卓越愈合功能的糖多肽水凝胶,也揭示了设计高性能止血和愈合水凝胶的有用原理。
原文链接:
https://doi.org/10.1002/adfm.202105628
——
更多新潮科研资讯,欢迎持续关注创化科技服务#材料轻Talk专栏!
特别鸣谢:时简
参考文献:
[1] Fu, K., H.G. Wu, and Z.Q. Su, Self-assembling peptide-based hydrogels: Fabrication, properties, and applications. Biotechnology Advances, 2021. 49.
[2] Jonker, A.M., D.W.P.M. Lowik, and J.C.M. van Hest, Peptide- and Protein-Based Hydrogels. Chemistry of Materials, 2012. 24(5): p. 759-773.
[3] Zhang, Y.S. and A. Khademhosseini, Advances in engineering hydrogels. Science, 2017. 356(6337).
[4] 刘群峰 and 原波, 多肽水凝胶的研究进展. 现代化工, 2011. 31(02): p. 29-33.
[5] Ding, X., et al., Synthetic peptide hydrogels as 3D scaffolds for tissue engineering. Advanced Drug Delivery Reviews, 2020. 160: p. 78-104.
[6] Zhang, Z.H., et al., Peptide-based supramolecular hydrogels for local drug delivery. Advanced Drug Delivery Reviews, 2021. 174: p. 482-503.
[7] Li, H., X.D. Shi, and J.L. Li, Self-Assembled Peptide Hydrogel for Biomedical Applications. Progress in Chemistry, 2022. 34(3): p. 568-579.
[8] 戴江东, 环境响应性自组装多肽水凝胶的研究进展. 江苏科技信息, 2020. 37(13): p. 30-34.
[9] Gao, Y.S., K. Peng, and S. Mitragotri, Covalently Crosslinked Hydrogels via Step-Growth Reactions: Crosslinking Chemistries, Polymers, and Clinical Impact. Advanced Materials, 2021. 33(25).
[10] Correa, S., et al., Translational Applications of Hydrogels. Chemical Reviews, 2021. 121(18): p. 11385-11457.