- 科研动态
- Research Dynamics




骨质疏松症是一种全球性的慢性骨病,通常是由于缺乏雌激素而引起,其特征是骨量逐渐减少,骨质量降低,导致骨脆性风险大大增加。在骨中,破骨细胞通过局部泌酸以及释放骨基质降解酶完成骨的吸收和降解,故目前临床上,骨质疏松症的治疗主要依赖于破骨细胞对骨损伤的抑制作用。例如使用双磷酸盐、地诺单抗、特瑞帕替德等化学物质抑制骨吸收,然而这些治疗药物可能会引起肾毒性、骨坏死、形成骨肉瘤等严重的副作用。

具体而言,以含1,4-苯二甲酸单元的聚醚为结构单元,4,4′-联吡啶为共配体,Cu离子为金属配位中心,制备了polyCu-MOF。随后,使用polyCu-MOF作为一种新载体,用于装载大量的Ag NPs(即获得polyCu-MOF@AgNPs)。使用聚合物为共配体制备的poly-MOFs表现出增强的稳定性、多级孔隙率,以及可控的形貌;此外,与使用小分子作为配体开发的MOF相比,由于共配体的存在,poly-MOFs的溶液稳定性可以得到显著提高。

研究人员设计了一种新型纳米催化药物:钙黄绿素(CN)修饰的钙铝层状双金属氢氧化物(CaAl-LDH)纳米片CALC,该纳米片利用酸中和和免疫微环境调节策略建立了一种高效的骨质疏松症免疫治疗模式。
CaAl LDH是通过均匀碱化方法制备的。为了提高CaAl-LDH对骨的靶向效率并减少对正常组织的潜在损伤,研究人员用钙黄绿素(CN)修饰CaAl-LDH纳米片得到CALC,其可与骨表面的钙特异性结合。
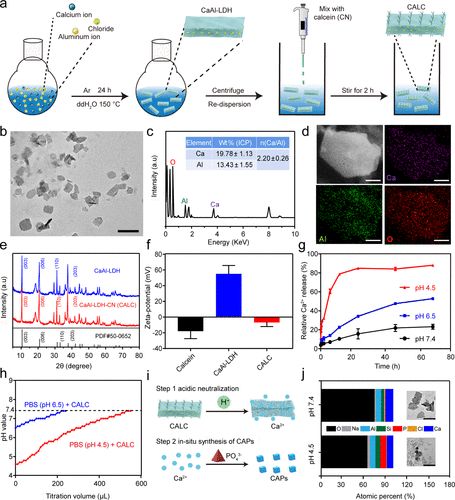

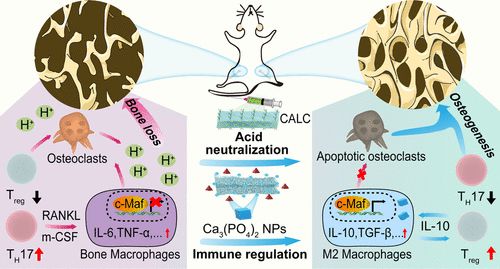
1.温和碱性的CALC纳米片可以中和骨质疏松症病变部位过量的质子(H+),从而介导破骨细胞的凋亡,同时被降解释放出钙离子。
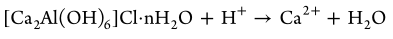
2.释放的钙离子与内源性磷酸盐反应生成磷酸钙纳米粒(CAPs),并通过激活c-Maf转录因子,产生大量IL-10,刺激骨巨噬细胞向M2表型极化。
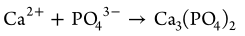
3.抗炎表型M2巨噬细胞通过分泌抗炎细胞因子,募集Treg,抑制T辅助细胞(TH17),进一步调节骨免疫微环境,促进成骨和骨形成进。
体外和体内实验结果均显示出CALC对骨质疏松症具有良好的治疗效果,股骨的每组织体积骨量BV/TV(%)从6.2显著提高到10.7,表明通过酸中和和免疫调节相结合的治疗理念具有很高的可行性。这种基于无机纳米材料的策略为顽固性骨质疏松症的治疗提供了一种新颖、高效、生物安全性良好的治疗模式,有望使骨质疏松症患者受益。
更多新潮科研资讯,欢迎持续关注创化科技服务#疾病限定月专栏!
说明:
本研究结果以题目为“Acid Neutralization and Immune Regulation by Calcium–Aluminum-Layered Double Hydroxide for Osteoporosis Reversion”发表在JACS杂志上。第一作者为Hao Fu,通讯作者为施剑林院士、胡萍副研究员和倪大龙教授。
特别鸣谢:
Spring